Voor de eerste keer ooit, hebben de wetenschappers gebruikten de CRISPR-gen-editing tool om de behandeling met succes een erfelijke spierziekte in een levende volwassen zoogdier. Het is een veelbelovende medische doorbraak die kan al snel leiden tot menselijke therapieën.
Wetenschappers hebben moeite om de behandeling van de ziekte van Duchenne voor decennia. Tot op heden, hun inspanningen zijn gericht op de behandeling van gekweekte cellen in petrischalen, of in probeert te krijgen CRISPR/cas9, een krachtige DNA-knip-en-plak-gereedschap voor het leveren van de hersteld exemplaar van de defecte genen effectief en veilig. Nu, met behulp van een speciaal gemodificeerd virus, onderzoekers van Duke University hebben bevestigd dat een veelbelovende oplossing met behulp van live-muis-modellen. Het team studie verschijnt in de nieuwste editie van Science.
Duchenne spierdystrofie is een spier verspillen ziekte die één op de 5.000 voor een pasgeboren jongen. De genetische glitch is op het X-chromosoom, dus meisjes twee X-chromosomen hebben de neiging om ten minste één werkende kopie van het gen. De symptomen verschijnen meestal tussen de leeftijd van 3 en 5, waarna de aandoening vordert snel. De meeste jongens zijn niet in staat om te lopen tegen de tijd dat ze 12 is, en ze moeten op den duur een masker om te ademen. De levensverwachting is tussen de 20 en 30 jaar.
De genetische aandoening wordt veroorzaakt door de afwezigheid van dystrofine, een erg belangrijke lange-eiwit keten dat houdt de integriteit van de spieren. Dystrofine is gecodeerd door een gen met bijna 80 eiwit-coderende regio ‘ s genoemd exons. Als zelfs een enkele exon is slecht gemuteerd, is de keten niet gebouwd worden. En zonder dystrofine, spieren langzaam af.
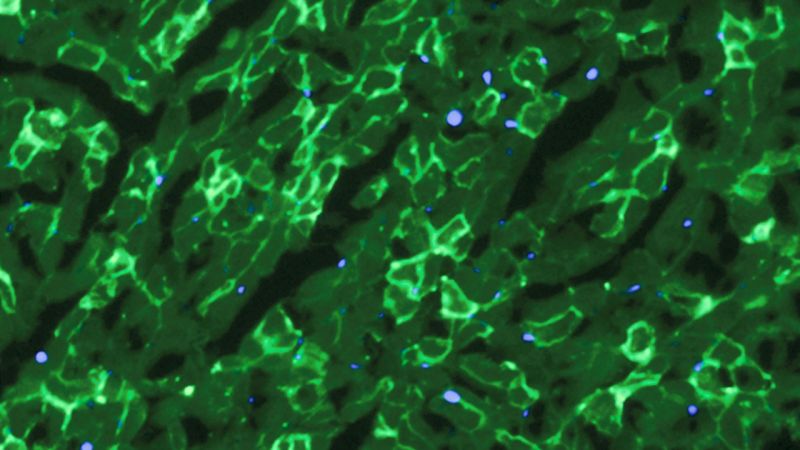
De gerestaureerde productie van dystrofine (licht groen) in de spier cellen van muizen. Credit: C. E. Nelson et al., 2015
De Hertog onderzoekers, onder leiding van geneticus Chris Nelson, gebruikt CRISPR/cas9 verwijderen van het beschadigde DNA, dat moest voorkomen dat de cellen van de productie van dystrofine.
Gesponsord
CRISPR, een tool die ontstond drie jaar geleden, kunnen wetenschappers voor het bewerken van het genoom met een ongelooflijke precisie en flexibiliteit. Als een persoon in het oplossen van een puzzel, het systeem maakt gebruik van synthetisch DNA bekend als CRISPRs voor het scannen van een genoom op zoek naar de juiste plek. Een eiwit genaamd cas9 werkt als een schaar te snijden door middel van het DNA.
Voor het leveren van deze genetische veranderingen, de Hertog onderzoekers gebruikten een soort van niet-pathogene virus. “Een belangrijke hindernis voor het gen, het bewerken van de levering. We weten welke genen moeten worden vastgesteld voor bepaalde ziekten, maar het verkrijgen van de gen-editing tools waar ze naartoe moeten is een enorme uitdaging,” zei Nelson in een release. “De beste manier waarop we het nu doen is om het voordeel van virussen, omdat ze miljarden jaren evolueren om erachter te komen hoe hun eigen virale genen in de cellen.”
Voor de studie, de onderzoekers werkten met genetisch gemodificeerde muizen die hadden de slopende mutatie op één van de exons van het dystrofine-gen. De wetenschappers is geprogrammeerd op de nieuwe CRISPR/cas9 systeem om onkruid uit de disfunctionele exon, waardoor het lichaam de natuurlijke repair system steek de resterende gen terug samen. Het resultaat was een verkorte, maar functionele versie van het gen.
Om elke spier, en het virus werd geïnjecteerd in de bloedbaan van de muizen. De resultaten vertoonden meetbare correcties van de spieren in het hele lichaam, waaronder het hart—een belangrijk resultaat, gezien het feit dat hartfalen is de belangrijkste doodsoorzaak van Duchenne-patiënten.
Echter, de muizen die de therapie niet zo goed doen als normale muizen op spiertesten, dus het is niet te genezen. Dat gezegd hebbende, zijn de onderzoekers van mening dat er veel ruimte is voor verbetering en dat ruim 80 procent van de mensen met DMD kunnen profiteren van het hebben van een defecte exon verwijderd.
“Er is nog een aanzienlijke hoeveelheid werk te doen om dit te vertalen naar een menselijke therapie en tonen veiligheid,” zei de Hertog onderzoeker Charles A. Gersbach. “Maar deze resultaten zijn afkomstig van onze eerste experimenten zijn erg spannend. Vanaf hier zullen we het optimaliseren van het systeem van de levering, de evaluatie van de aanpak in meer ernstige modellen van DMD, en de beoordeling van de efficiëntie en de veiligheid in de grotere dieren, met het uiteindelijke doel om in klinische studies.”
Twee andere teams—alle werken onafhankelijk van elkaar—bereikte vergelijkbare resultaten in hun onderzoek. Deze studies werden uitgevoerd door Eric Olson aan de Universiteit van Texas Southwestern Medical Center en Amy Inzet aan de Universiteit van Harvard.
In tegenstelling tot de inspanningen voor het wijzigen van de kiembaan van embryo ‘ s, is deze aanpak kan worden toegepast op een levend wezen. Dit betekent dat de genetische veranderingen kunnen worden ingevoerd later in het leven, en ze zijn niet erfelijk.
“De recente discussie over het gebruik van CRISPR om de juiste genetische mutaties in menselijke embryo’ s heeft terecht gegenereerd grote bezorgdheid over de ethische implicaties van een dergelijke aanpak,” zei Gersbach “Maar met CRISPR om de juiste genetische mutaties in de aangetaste weefsels van zieke patiënten wordt niet ter discussie. Deze studies tonen een pad waar dat mogelijk is, maar er is nog een aanzienlijke hoeveelheid werk te doen.”
[Duke University, New York Times, Wetenschap AAAS]
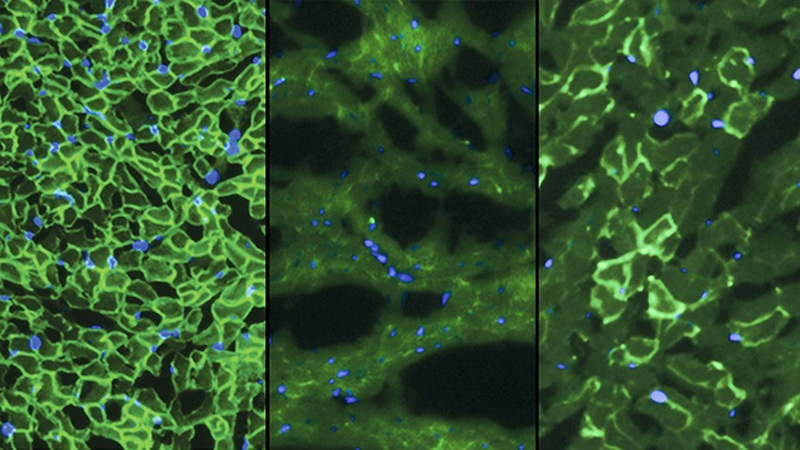
E-mail de auteur george@gizmodo.com en volg hem op @dvorsky. Bovenste afbeelding: Dystrofine (licht groen) is te zien in de hartspier van normale muizen (links), ontbreekt in muizen met DMD (midden), en deels hersteld van Duchenne muizen behandeld met CRISPR/Cas9 (rechts). Credit: C. E. Nelson et al., 2015