 NIH
NIH
Deze week markeert een belangrijke mijlpaal in de geneeskunde: Op woensdag, een Food and Drug Administration panel is unaniem aanbevolen de goedkeuring van de eerste AUTO-T therapie, een baanbrekende nieuwe kanker geneesmiddel van Novartis dat genetisch ingenieurs een patiënt de eigen witte bloedcellen te herkennen en aan te vallen de kankercellen een inbreuk op hun lichaam.
De koppen werden nadrukkelijk. “Eerste gentherapie—’een echte woon-drug’—op het punt van de goedkeuring van de FDA,” the Washington Post aangekondigd. “De FDA Panel Rug Novartis’ Baanbrekende Nieuwe Kanker Gentherapie,” aldus Reuters.
En dan, in een ware internet-tijdperk fashion, kwam de classicus:
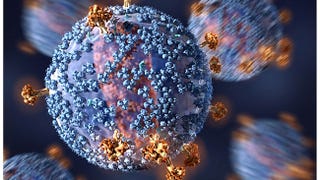
In een wereld waarin “eerste” kunnen betekenen clickier krantenkoppen, meer tractie en uiteindelijk nog meer onderzoek dollar, het is een label dat van belang is. Het is duidelijk dat de drug—de bijna onuitspreekbare tisagenlecleucel—is een mijlpaal. AUTO-T-therapie, waarbij verschillende andere bedrijven zijn ook het nastreven van drugs voor, werkt door het extraheren en het isoleren van een patiënt met T-cellen, genetisch veranderen van hen, en dan het inbrengen van hen terug in het lichaam van de patiënt. In één belangrijke klinische proef, 83 procent van de 52 patiënten bij wie chemotherapie niet werkt bereikt een volledige of gedeeltelijke kwijtschelding van de drie maanden na hun AUTO-T infuus. Na een jaar 79 procent van de patiënten nog in leven waren.
Het is minder duidelijk, wat, precies, Novartis’ baanbrekende drug misschien wel de eerste van.
De FDA, voor een, bepaalt de menselijke gentherapie vaag als “producten introduceren van genetisch materiaal in het DNA van een persoon te vervang defecte of ontbrekende genetisch materiaal, dus de behandeling van een ziekte of abnormale medische aandoening.”
Het agentschap merkt op dat, tot nu toe, geen product is goedgekeurd voor verkoop in de VS.
Op Twitter, wetenschappers en journalisten voerden over de vraag of die definitie van gentherapie betekende het gen zelf moet worden voor de behandeling—als dat zo is, AUTO-T niet in aanmerking zouden komen, want het is de opgevoerde witte bloedcellen die de behandeling, in plaats van de genen die toegevoegd zijn aan hen. De bewerkingen niet direct te corrigeren een biologische afwijking. Gentherapieën, dit kamp zou kunnen zeggen, vereisen meer bewerken, en AUTO-T is gewoon een cel therapie.
Anderen betoogden dat alles wat met genetische modificatie gekwalificeerd als gentherapie, waardoor het misschien AUTO-T de eerste. (Hoewel anderen stelden dat onder die definitie, een ander geneesmiddel zou eigenlijk in aanmerking komen voor de titel.)
In het einde, de pedante debat misschien niet zoveel uit—misschien punten in plaats van een verschuiving van de definities, de perceptie dat genetische veranderingen zijn steeds meer de oplossing voor alles.
In de tussentijd, het panel aanbevolen dat de FDA goedkeuring van het geneesmiddel voor patiënten leeftijden 3 tot en met 25 met recidief van de B-cel acute lymfatische leukemie, de meest voorkomende vorm van kanker bij kinderen in de VS. Het agentschap hoeft niet te volgen dat de aanbeveling, maar meestal niet. Het zal naar verwachting een besluit in September. Na goedkeuring, Novartis heeft gezegd dat het plannen van een trage roll-out als gevolg van ernstige bijwerkingen die het gevolg zijn van de therapie, vooral het beschikbaar maken voor slechts een paar dozijn medische instellingen.
De FDA ‘ s afwachting van de beslissing zou kunnen hebben grote gevolgen voor andere bedrijven met de ontwikkeling van vergelijkbare behandelingen, zoals Kite Pharma en Juno Therapeutics. En grote gevolgen voor patiënten, of we regelen op te roepen gentherapie of niet.