 Artista rappresentazione di X-raggi che passano attraverso un cristallo. Credito: SLAC National Accelerator Laboratory.
Artista rappresentazione di X-raggi che passano attraverso un cristallo. Credito: SLAC National Accelerator Laboratory.
Ora c’è un modo migliore per l’immagine della struttura interna delle molecole biologiche su scala atomica, usando un potente x-ray laser. Questo potrebbe portare ad importanti novità nelle tecnologie di energia pulita e lo sviluppo di farmaci, tra gli altri usi.
I cristalli sono definite dalla loro regolari, grata, come matrici di atomi, e gli scienziati in genere si basano su una tecnica chiamata la cristallografia a raggi x per l’immagine che la struttura interna. Ma il più disordinato cristallo, la peggiore è la risoluzione dell’immagine. I fisici a DESY in Germania e Linac Coherent Light Source (LCLS), un impianto a SLAC National Accelerator Laboratory hanno combinato cristallografia con singola molecola di imaging a prendere immagini ad alta risoluzione anche con disordinata cristalli. I loro risultati sono stati pubblicati oggi in Natura.
Il campo della cristallografia a raggi x, risalente agli inizi del 20 ° secolo. Da allora, gli scienziati hanno usato questo metodo per capire la struttura atomica di un vasto numero di materiali in fisica, chimica e biologia. Brillano i raggi x su cristallo e si rimbalzano gli atomi che compongono il cristallo. Questa dispersione possono essere raccolti da un rivelatore, e la conseguente pattern di diffrazione avrà un sacco di punti luminosi. Questi sono conosciuti come “i picchi di Bragg.” Misurando quelle vette, gli scienziati sono in grado di dedurre il cristallo della struttura interna.
“Cristallografia sarebbe come stare in piedi di fronte a una foresta e calci miliardi di palloni da calcio.”
Sebastian Boutet, un’attrezzatura scienziato LCLS e co-autore sulla carta, disegna un’analogia con un ri-piantato una foresta con alberi allineati in modo identico, perfetto righe. “Cristallografia sarebbe come stare in piedi di fronte a una foresta e calci miliardi di palloni da calcio”, ha detto Gizmodo via e-mail. Alcuni palloni da calcio ha colpito il primo albero in una riga, mentre altri di penetrare più in profondità nella foresta e colpire altri alberi. “Dopo aver colpito un albero, c’è solo un certo insieme di indicazioni che possono rimbalzare e ancora trovare un modo per uscire di forect, senza colpire un altro albero”, ha detto Boutet.
Quegli angoli di direzione sono simili picchi di Bragg. Gli scienziati possono contare il numero di “soccer balls” è emerso da ogni direzione per determinare la dimensione e la forma dell’albero. Scontato, è in perfetta analogia; probabilmente c’è un modo più semplice per misurare gli alberi in una foresta. Ma per oggetti più piccoli, come gli atomi in una molecola come una proteina, i ricercatori devono ricorrere a metodi diversi, e la cristallografia ha dimostrato la sua utilità di volta in volta nel corso dell’ultimo secolo.
Sponsorizzato
Se hai avuto perfettamente ordinato di cristallo, si otterrebbe nulla, ma Bragg picchi. Ma è davvero difficile ottenere tutte quelle metaforico alberi allineati in modo così preciso. “Quando i cristalli sono disordinati, i picchi di Bragg non può più esistere, in quanto la matrice di alberi non è perfetto,” ha detto Boutet.
 Rappresentazione artistica di un imperfetto di cristallo, con la ripetizione di unità ritratta come una serie infinita di anatre. Credito: SLAC National Accelerator Laboratory.
Rappresentazione artistica di un imperfetto di cristallo, con la ripetizione di unità ritratta come una serie infinita di anatre. Credito: SLAC National Accelerator Laboratory.Anche se non è possibile ottenere picchi di Bragg con disordinata cristalli, tutto ciò che di raggi x di energia hai fulminato con ancora rimbalza indietro, ma questa volta si forma un pattern chiamato continuo di diffrazione.
Rivisitare la foresta analogia, “Invece di calciare la palla a un intera foresta per capire la media forma di un albero, sarebbe molto più facile per calciare la palla a un albero, e capire la forma in cui le palline rimbalzano”, ha detto Boutet, molto simile a quello che avviene con il singolo di imaging molecolare. “In questo caso, perché le palline rimbalzano l’albero non sarebbe limitata ad un paio di angoli, non sarebbe di raccogliere presso i singoli punti (picchi di Bragg), ma invece di distribuire più uniformemente continua (diffrazione).”
Si scopre che questo ultimo modello contiene molte più informazioni di una molecola, struttura, perché non c’è informazione, non solo a picchi di Bragg, ma tra di loro. Questo a sua volta produce una migliore risoluzione rispetto a quella che è stato possibile con il tradizionale cristallografia. In sostanza, imperfetto (disordinati), i cristalli hanno sia i picchi di Bragg e non Bragg segnali di singolo imaging molecolare, in modo che questo nuovo approccio sfrutta il meglio di entrambi i mondi.
Annuncio
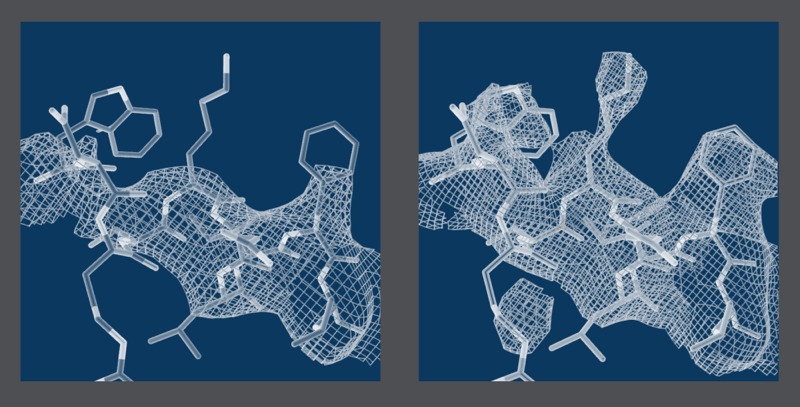 Confronto di risoluzione immagine ottenuta da convenzionali di cristallografia (a sinistra) e il metodo di combinazione (a destra). Credito: Dominik Oberthuer e Kartik Ayyer, DESY.
Confronto di risoluzione immagine ottenuta da convenzionali di cristallografia (a sinistra) e il metodo di combinazione (a destra). Credito: Dominik Oberthuer e Kartik Ayyer, DESY.
Conoscere la struttura precisa di molecole biologiche è fondamentale quando si tratta di applicazioni del mondo reale. Prendere il farmaco di progettazione e sviluppo di un caso in punto. L’obiettivo qui è quello di progettare molecole per contrastare quelle che danno luogo a malattie. Boutet confronta con una chiave e una serratura. Un virus, per esempio, ha un “buco” o “lock” con cui si può attaccare ad un corrispondente “chiave” su alcune molecole vitali nel vostro corpo. Questo disattiva in modo efficace e consente al virus di diffondersi. Se si potesse progettare un farmaco la cui molecole efficacemente la spina del foro, il virus dovrebbe essere disattivato, invece. Ma per fare questo, avete bisogno di conoscere l’esatta posizione di tutti gli atomi in quelle molecole.
Finora, il team ha utilizzato il loro metodo su un solo tipo di molecola: fotosistema II. Hanno scelto perché è altamente efficiente e fotosintesi: utilizzare la luce solare per trasformare l’acqua in ossigeno, mentre la fornitura di energia per le piante o batteri. “Nessun uomo sistema si avvicina al livello di efficienza raggiunto dalla natura, in questo caso,” ha detto Boutet. “Quindi questo potrebbe essere un percorso per lo sviluppo di nuove [clean] tecnologie per l’energia, copiando la natura”.
Essi sono fiduciosi di poter estendere il loro metodo per molti altri tipi di biomolecole in futuro. Un potenziale ostacolo è se questa tecnica di lavoro in altre strutture. X-ray laser come quella LCLS sono estremamente potenti, permettendo ai ricercatori di acquisire i dati molto velocemente. Questo è importante perché il più a lungo il campione deve essere esposto ai raggi x, maggiore è il rischio di danni. Altre sorgenti di raggi x, come sincrotroni, non sono così potenti e così i campioni avrebbe bisogno di lunghe esposizioni.
Tuttavia, “una Volta che il pieno potenziale del nuovo metodo è capito, potrebbe rivelarsi uno dei miglioramenti più importanti dalla nascita di cristallografia,” LCLS regista Mike Dunne ha detto in una dichiarazione.
[Natura]
